さいえんす・すてーしょん
2024.2.29

どうして化学反応が起きるのか?
第3回 イオン結合

酸と塩基によって起こる中和反応で精製される塩は、陽イオンと陰イオンがクーロン力によって結びついた、イオン結合物質です。
原子は最外殻にある電子を受け渡すことでイオン化し、陽イオンや陰イオンが生まれます。
▽目次
1.非金属元素と金属元素
2.イオン結合
・塩化ナトリウム(NaCl)
・最外殻を埋めたい
・NaからClに電子を渡す
・NaClが作られる化学反応
・塩化カルシウム(CaCl2)
3.イオン結合の表しかた
4.非金属元素どうしのイオン結合
5.まとめ
6.練習問題
非金属元素と金属元素
イオン結合は基本的に金属元素と非金属元素の間で結合します。
半金属はその名の通り、金属と非金属の中間の性質を持つ元素です。
イオン結合 イオン結合とは、化学結合の中で2番目に強い結合です。(1番は共有結合)
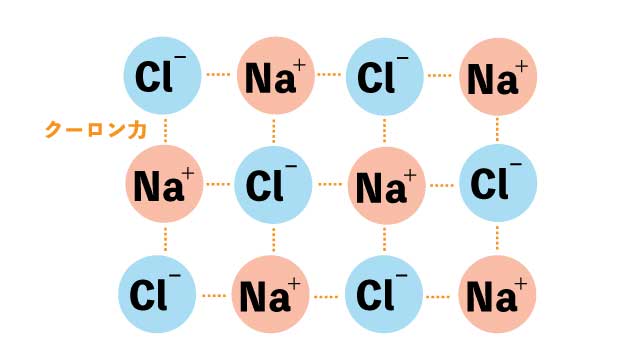
塩化ナトリウム(NaCl) まずはイオン結合の代表例である、塩化ナトリウム(NaCl)の結合を見てみましょう
最外殻を埋めたい 原子は安定のため、もっとも外側にある電子殻を埋めたいと思っています。
参考:それぞれの電子殻に入ることができる電子の数 ※M殻は8個で一度安定 NaからClに電子を渡す Naは最外殻には電子が1つしかないので、これを渡してしまいたい。(電子を1つ手放したい!)
ナトリウムは電子を1つ手放しているので、価数は1となり、1価の陽イオンとなります。
NaClが作られる化学反応 NaClはイオン結合物質(塩)なので、酸と塩基の中和反応によってつくられます。
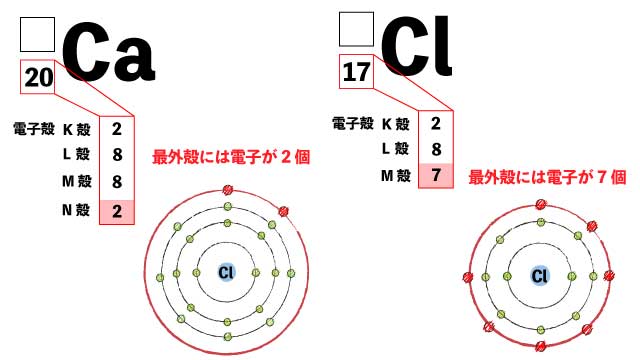
塩化カルシウム(CaCl2) 同じくイオン結合を行う塩化カルシウムについて考えてみましょう。
Caは2つ電子を手放したいですが、Clは1つしか受け取りたくありません。
Caは電子を1つ手放しているので、価数は2となり、2価の陽イオンとなります。
イオン結合の表しかた 化学式で表す場合は、組成式で表します。
例:NaCl……Na+とCl-が1:1の割合で結合
なお、共有結合は分子式で表されます。
例:HCl……H原子が1つ、Cl原子が1つ の結合
組成式と分子式を区別できるようにしておきましょう。
非金属元素どうしのイオン結合 イオン結合は基本的に金属元素と非金属元素の間で発生しますが、例外も存在します。
NH3(アンモニア)にH+(水素イオン(陽イオン))が配位結合して、NH4+になります。
塩化アンモニウムは、この陽イオンNH4+が陰イオンCl-とイオン結合してできています。
まとめ
練習問題 問1 マグネシウムと塩素の最外殻の電子の数はそれぞれ何個か。 問2 マグネシウムは金属元素である。〇か×か。 問3 マグネシウム、塩素のそれぞれの価数を求めよ。 問4 マグネシウムは陽イオンになる。〇か×か。 問5 マグネシウムと塩素がイオン結合してできた、塩化マグネシウムの組成式を書け。 問6 酸素とカルシウムがイオン結合してできた、酸化カルシウムの組成式を書け。
まずは金属元素について、周期表で確認してみましょう。
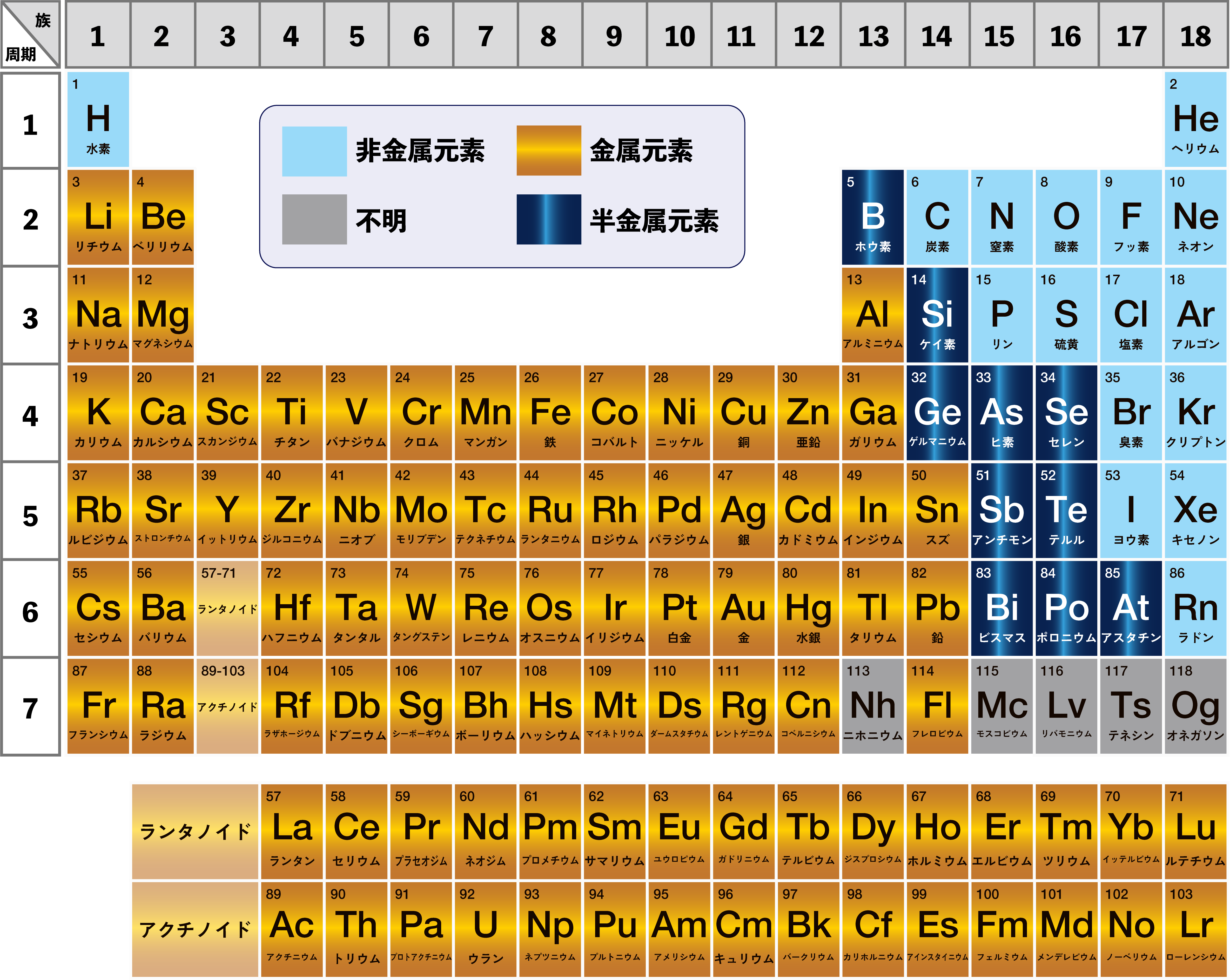
世界的な定義は存在せず、その範囲については諸説あります。
共有結合は非金属元素どうしが結合する化学結合ですが、基本的にイオン結合は金属元素と非金属元素の間で結合します。
酸と塩基の中和によって作られる「塩」は、イオン結合物質です。
原子が+もしくは-の電荷を帯びるとイオンとなります。
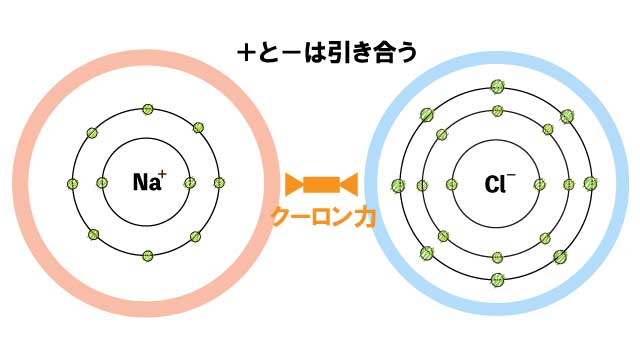
イオン結合は、陽イオン(+)と陰イオン(-)がクーロン力(静電気的な引力)で引き合って結合します。
共有結合では、お互いの最外殻にある電子を共有することで埋めることに成功しました。
イオン結合の場合は、一方の原子の最外殻電子を、もう一つの最外殻に渡すことで、お互いの最外殻を埋めます。
電子核
K殻
L殻
M殻
N殻
O殻
……
入れる
電子の数2
8
18
(8)32
50
2n2
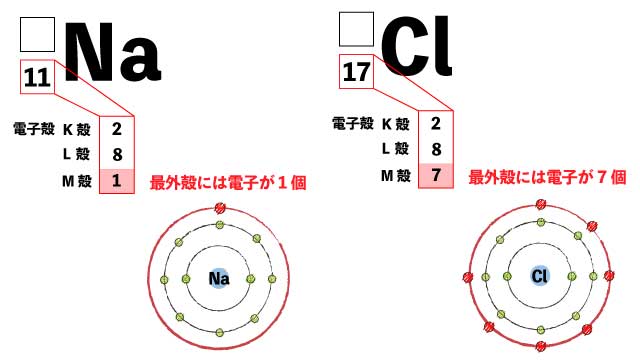
Clは最外殻に電子が7個あるので、あと1つあれば安定できる。(電子が1つ欲しい!)
このNaとClのお互いの思惑が一致した結果、どうなるかというと……。
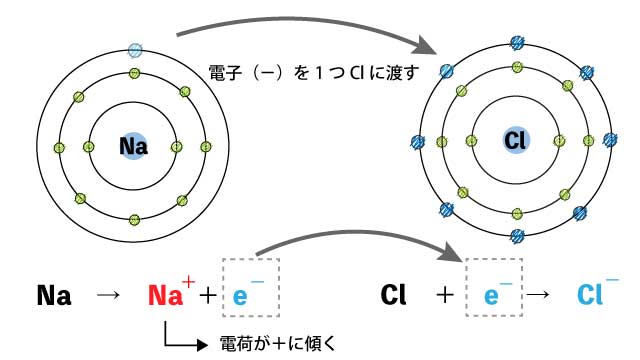
塩素は電子を1つ受け取っているので、価数は1となり、1価の陰イオンとなります。
ナトリウムの陽イオンNa+と塩素の陰イオンCl-はクーロン力で引き合い、結合します。
これがイオン結合です。

まずは最外殻の電子の数を確認します。
ですので、Clをもう1つ用意します。
(化学反応を考える際には、周囲に同種の原子が無限にあると考えます。)
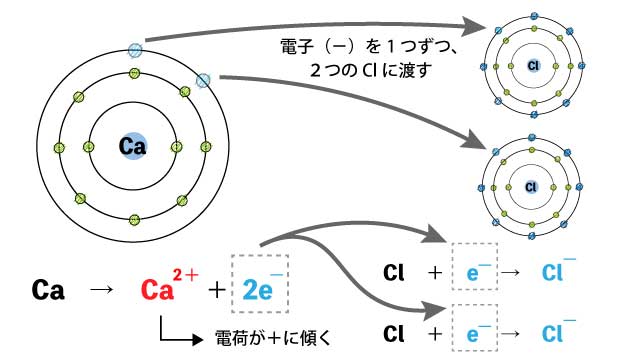
2つのCl原子は電子を1つずつ受け取っているので、価数は1となり、1価の陰イオンが2つできあがります。
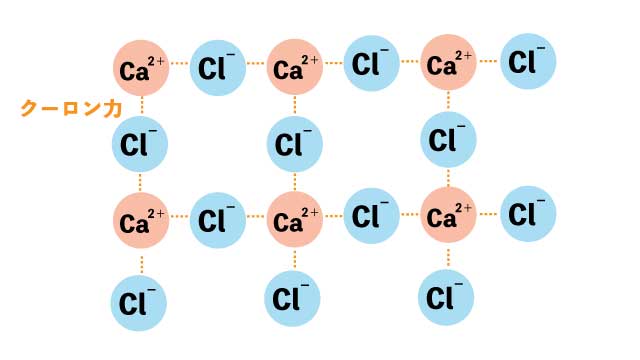
カルシウムの陽イオンCa2+と2つの塩素の陰イオンCl-はクーロン力で引き合い、結合します。
組成式はその物質を構成している原子を、もっとも単純な整数比で表したものです。
イオン結合している物質は、先に陽イオンを、後ろに陰イオンを表記します。
塩化ナトリウムは、ナトリウム(1価の陽イオン)と塩素(1価の陰イオン)の割合が1:1なので、NaCl。
塩化カルシウムの場合は、カルシウム(2価の陽イオン)と塩素(1価の陰イオン)の比が1:2なので、CaCl2と表します。
CaCl2……Ca2+とCl-が1:2の割合で結合
H2O……H原子が2つ、O原子が1つ の結合
金属元素以外でも、陽イオンになる場合です。
代表的な例として、塩化アンモニウム(NH4Cl)が挙げられます。
塩化アンモニウムは、N(窒素)、H(水素)、Cl(塩素)の化合物ですが、いずれも非金属元素です。
NとHは、共有結合で結ばれ、NH3となり、アンモニアが作られます。
塩化水素とアンモニアの中和反応を化学式で表すと、

✔ 電子をやりとりして、陽イオンと陰イオンがクーロン力によって結びつくことをイオン結合という。
✔ 中和反応で発生する塩はイオン結合物質である。
塩素は金属元素である。〇か×か。
塩素は陽イオンになる。〇か×か。
