さいえんす・すてーしょん
2023.3.29

どうして化学反応が起きるのか?
第1回 原子についての基礎知識

化学反応がどうして起こるのか、を知るためには、原子について知る必要があります。
今回は原子に関する基礎知識を身につけましょう。
原子が分かれば、なぜ酸素はOではなく、O2という形で存在するのかもわかるはず!
▽目次
1.原子についての基礎知識
・電荷
・原子番号=陽子の数=電子の数
・原子の質量数
・原子の表記法
2.電子殻について
3.化学結合の種類
4.まとめ
5.練習問題
原子についての基礎知識 原子とは物質を構成する最も小さな「粒」です。
電荷 電荷とは電気的なアンバランスさ(不安定さ)のことです。
原子番号=陽子の数=電子の数 原子の性質は陽子が1個なら水素、2個ならヘリウム……になるように、陽子の数によって決まります。
原子番号=陽子の数=電子の数 原子の質量数 原子の重さは陽子と中性子の数を数えた質量数で表します。
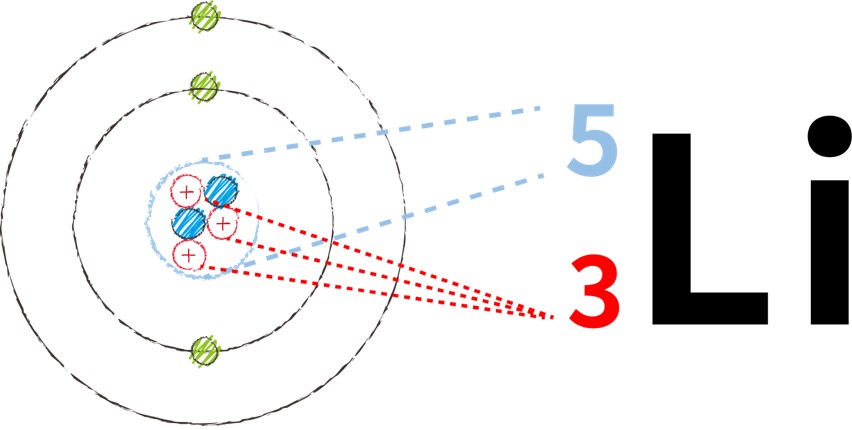
原子の表記法 原子は、元素記号に質量数と原子番号を足すことで表記できます。
【リチウム5の場合】
電子殻について 電子は原子核の周りを決まった軌道で動き回っています。
※8個で一時的に安定 それぞれの軌道に入れる電子の数は決まっており、内側の軌道から埋まっていきます。
化学結合の種類 化学結合には①共有結合、②イオン結合、③金属結合の3種類があります。
それぞれの結合の強さ順に並べると、↓の通りです。 まとめ
✔ 原子の電荷はゼロである。
練習問題 問1 炭素12の原子番号、陽子の数、中性子の数、電子の数をそれぞれ答えよ。 問2 酸素16の原子番号、陽子の数、中性子の数、電子の数をそれぞれ答えよ。 問3 中性子の数が12個のネオン原子の原子番号、陽子の数、電子の数、質量数をそれぞれ答えよ。 問4 中性子の数が20個のカリウム原子の原子番号、陽子の数、電子の数、質量数をそれぞれ答えよ。 【関連ページ】
原子は原子核をつくる陽子、中性子と、そのまわりにある電子のかたまりです。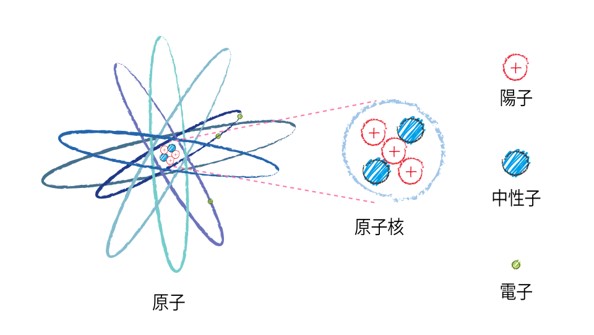
陽子はプラスの電荷を、電子はマイナスの電荷をもっています(中性子は電荷をもちません)。
原子の電荷は必ずゼロ(プラスの電荷とマイナスの電荷が釣り合っている状態)になります。
電荷がゼロでない陽子、中性子、電子のかたまりは原子ではなく、イオンと呼びます。
電荷
質量数
陽子
+
1
中性子
なし
1
電子
-
1/1840
陽子の数の順番に周期表は作られており、原子番号と陽子の数は一致します。
つまり、
電子はとても軽いので、原子の重さを質量数で表すときには省略します。
例えば、陽子が3個、中性子が2個、電子が3個の原子の場合、質量数は5となります。
式:陽子の数(3)+中性子の数(2)= 質量数(5)
質量数を利用して、どんな元素でできているかの分析を行うことができます。
左上には質量数(陽子の数+中性子の数)、左下には原子番号(=陽子の数)が入ります。
原子番号は周期表に掲載されているので、がんばって覚えましょう。
軌道はいくつも存在し、内側からK殻、L殻、M殻、N殻、O殻~という名前がついています。
殻とつくのは、実際の電子の軌道は球の形をしており、マトリョーシカのように何重にも重なっているからです。
紙やモニタ上で立体的に図示することは難しいので、基本的には↓の図のように簡略化した図で表します。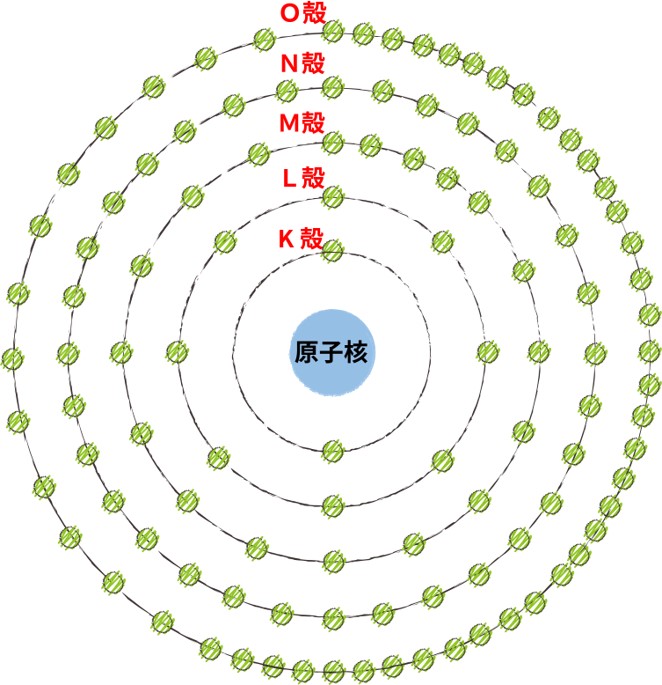
軌道
K殻
L殻
M殻
N殻
O殻
……
入れる
電子の数2
8
18
(8)32
50
2n2
そして原子たちは安定のため、最も外側にある電子殻をいっぱいにしたいので、化学結合を起こすのです。
(実際のところは、電子は波のような性質が現れる、濃淡のある雲のような軌跡に存在します。
しかし、化学反応式を説明する際のモデルとしてわかりにくいので、存在確率が高い場所を電子殻としたモデルを使用して説明するのが一般的です。)
また、それ以外に④分子間力による結合(水素結合、ファンデルワールス力による結合)が起こる場合もあります。
① 共有結合
原子同士が電子の一部を共有することで起きる結合
② イオン結合
原子と原子の間で電子のやり取りを行った結果、イオンとなった原子同士が静電気力(クーロン力)によって結びつくことで起きる結合
③ 金属結合
金属原子と金属原子が共有結合やイオン結合ができないときに、見かけ上、電子をたくさんの金属原子で共有しているように見せることで起きる結合
④ 分子間力による結合
分子間力に働く引力によって起きる結合。主にファンデルワールス力は電荷の偏りによって働く力であり、水素結合はその一種。すごく弱い。

✔ 原子番号=陽子の数=電子の数
✔ 原子軌道に入れる電子の数はそれぞれの軌道で決まっており、内側の軌道から埋まっていく。
✔ 原子は最も外側にある電子殻を最大数まで埋めたい。
✔ 化学結合の強さは 共有結合 > イオン結合 > 金属結合 >> 分子間力による結合


 原子番号 6
原子番号 6 原子番号 8
原子番号 8 原子番号 10
原子番号 10 原子番号 19
原子番号 19