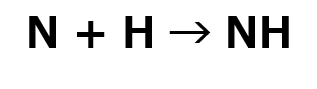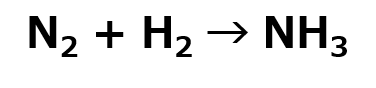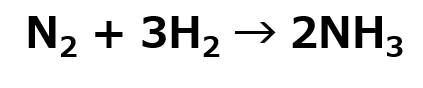さいえんす・すてーしょん
2023.9.27

どうして化学反応が起きるのか?
第2回 電子式~共有結合

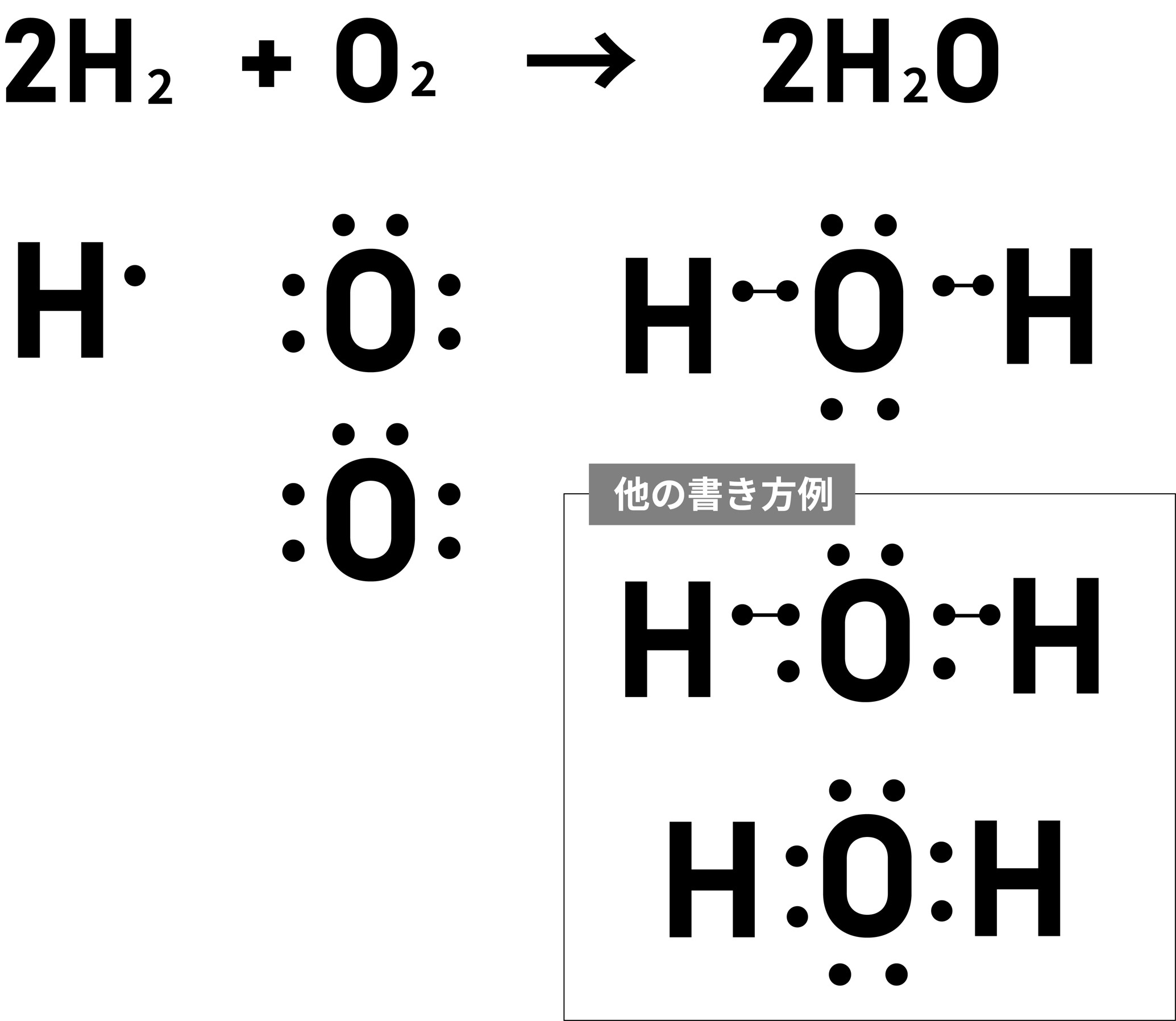
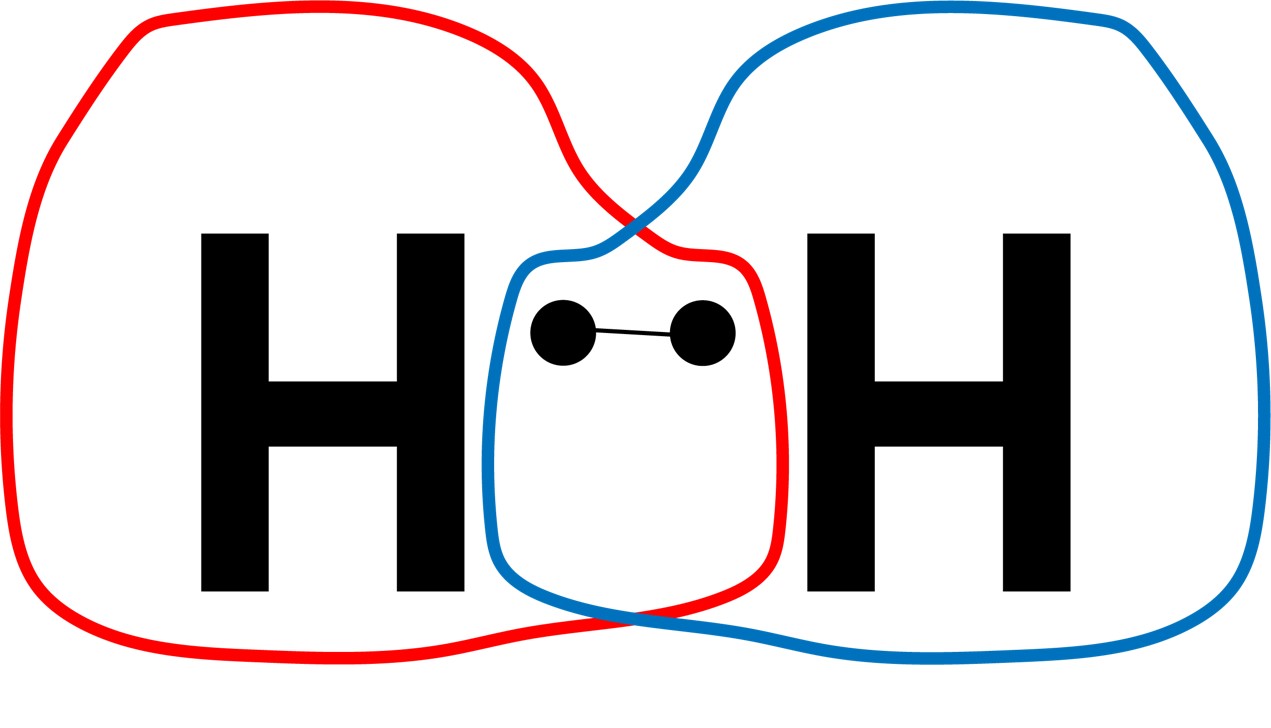
OがO2となり、HがH2となるのは、原子同士が共有結合しているからです。
この結合を理解するために、原子を電子式であらわしてみましょう。
最後にまとめとして、練習問題で水を生成する化学反応式を解くのにチャレンジしてみてください。
化学反応の種類
化学反応は主に、化学結合と化学分解の2種類が存在します。
・化学結合 …… 共有結合、イオン結合、金属結合、分子間力による結合
基本的に原子は結合することで安定したがるので、分解させたい場合は外からエネルギーを与えて分解させます。
最外殻を埋めたい 原子は安定のため、もっとも外側にある電子殻を埋めたいと思っています。
電子式で表してみよう 電子式は最外殻の電子を図示したものです。
参考:それぞれの電子殻に入ることができる電子の数
共有結合 2つ以上の原子で電子をペアにすることで安定する結合を、共有結合といいます。
原子はなんとか電子殻の最も外側を埋めて、安定させようとします。
HがH2となる理由(単結合) 2つの水素原子が電子を共有することで、それぞれ最外殻にある電子を2個にすることができました。
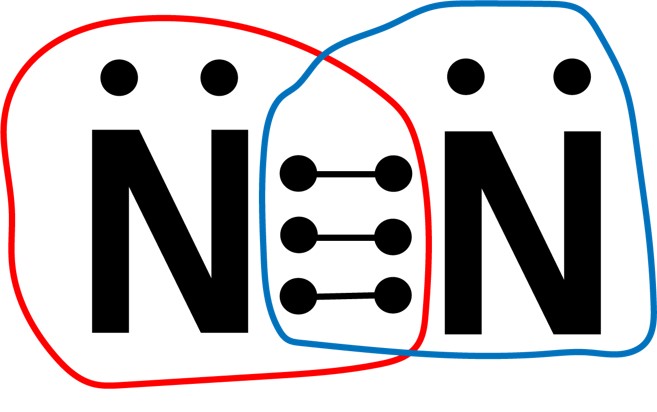
OがO2となる理由(二重結合) 2つの酸素原子が電子を共有することで、それぞれ最外殻にある電子を8個にすることができました。
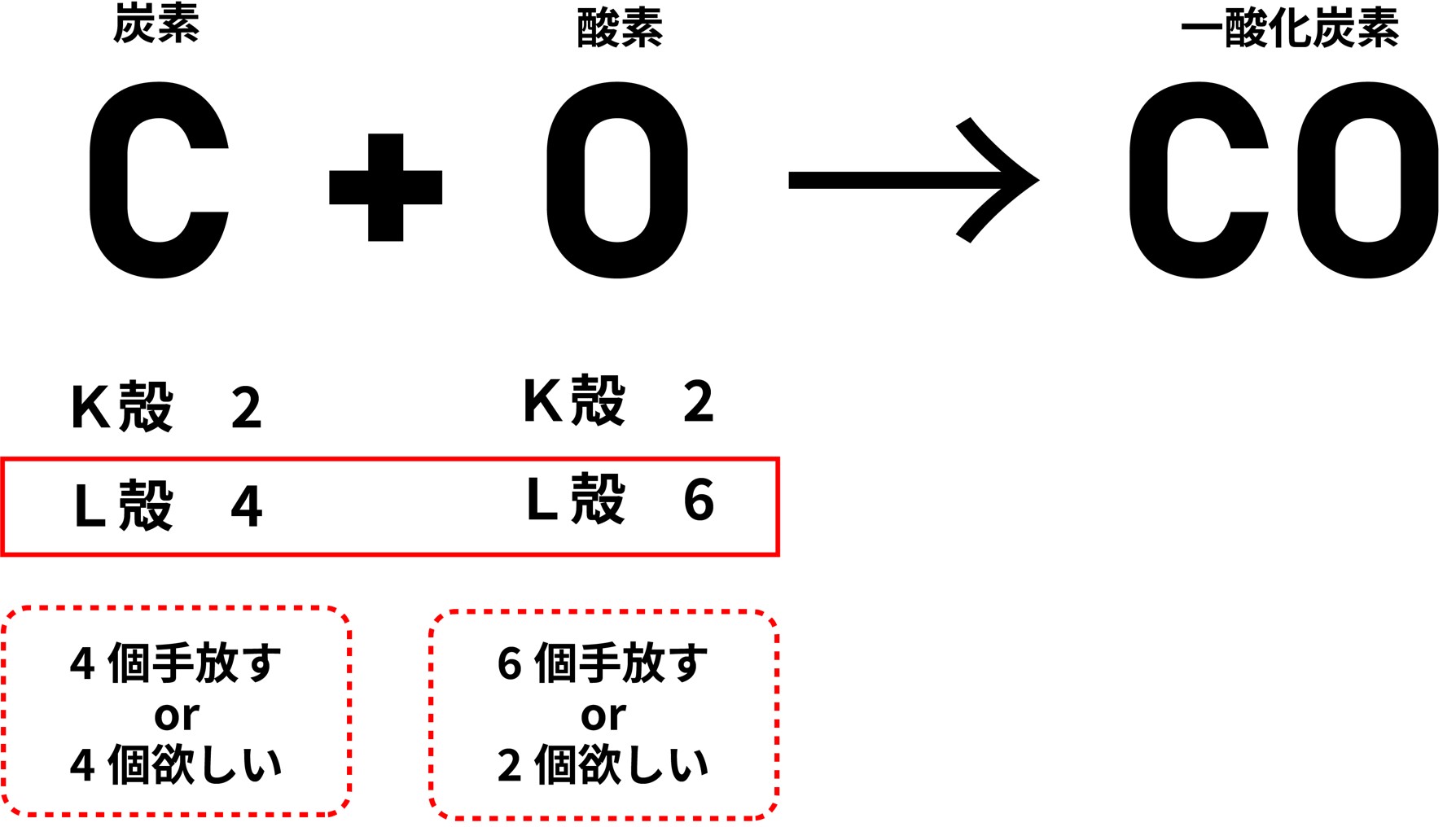
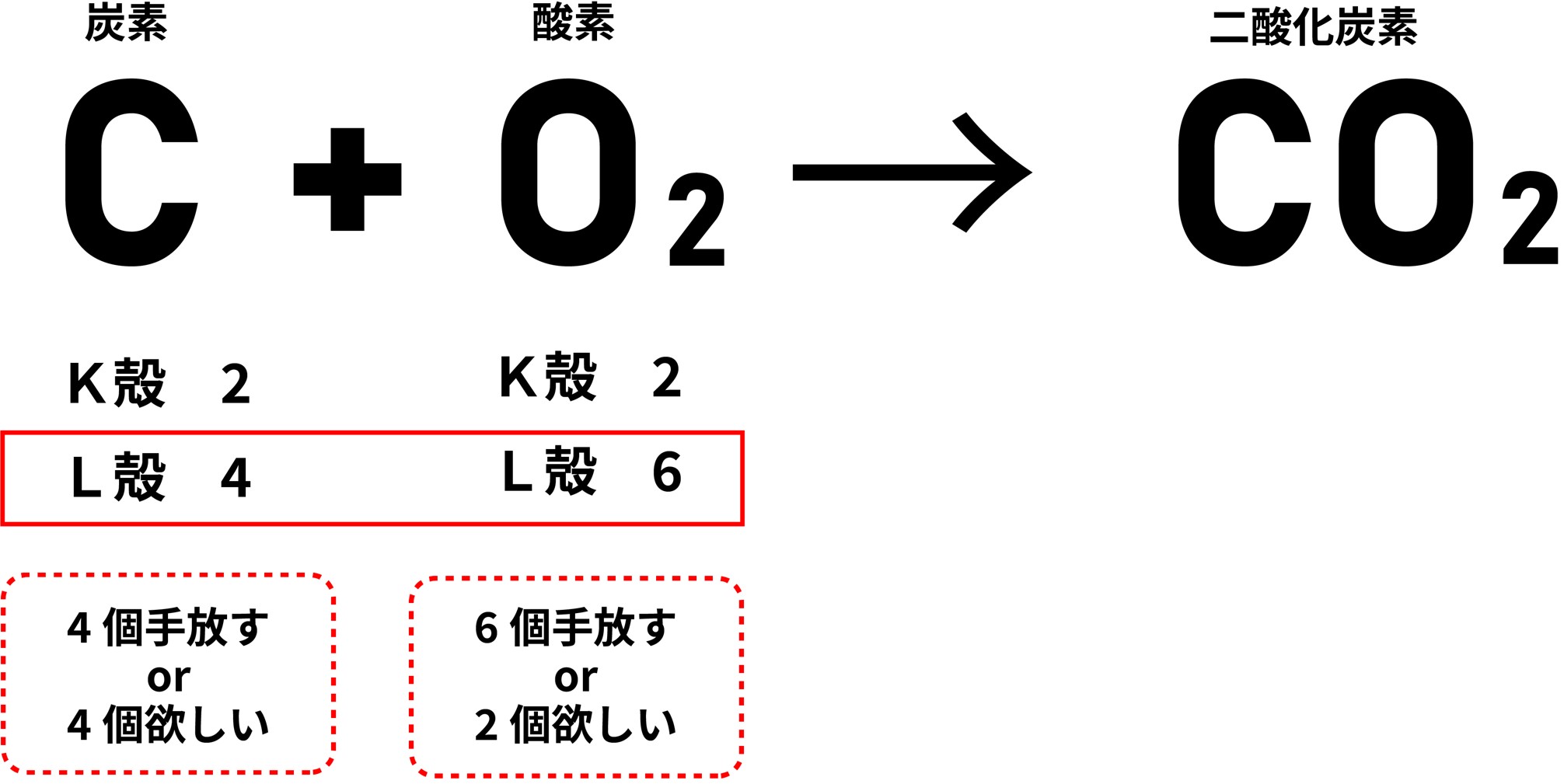
炭素を燃やそう 化学反応で有名な炭素の燃焼反応を考えてみましょう。
① まずは化学反応式と、それぞれの原子の最外殻にある電子の数を確認します。
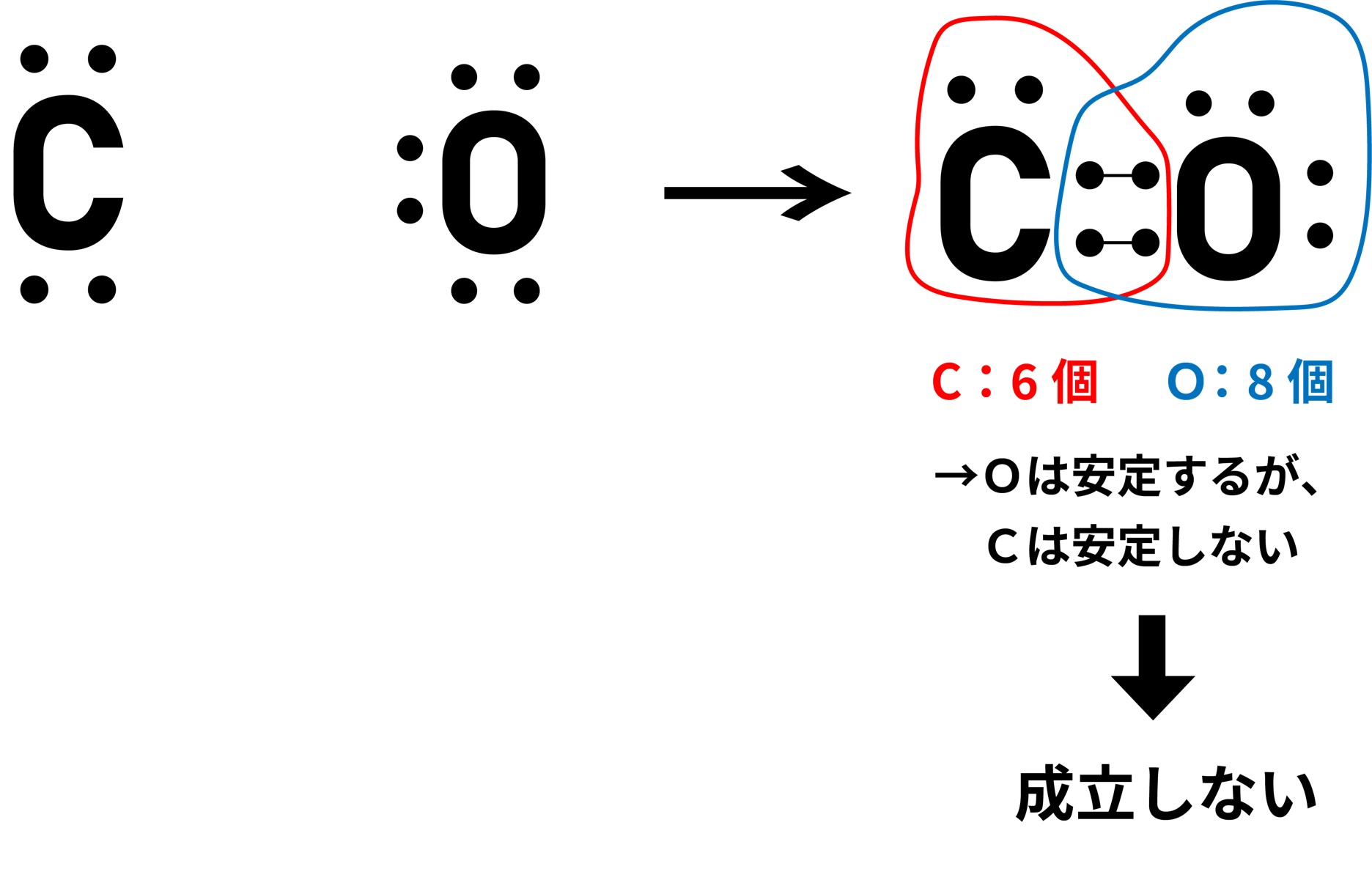
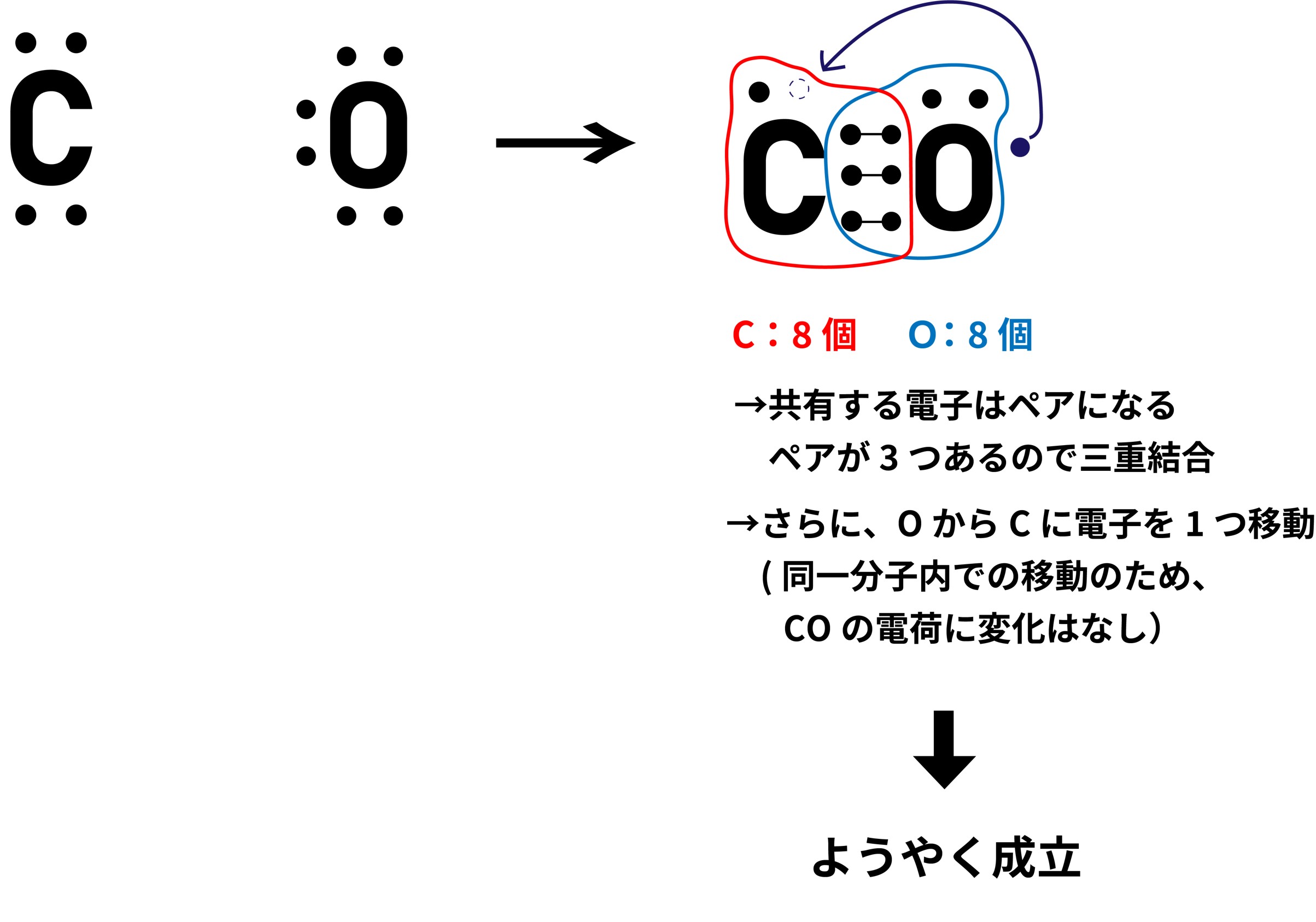
② 次に電子式を書いてみましょう。
炭素原子が酸素原子2つとそれぞれ二重結合することで、最外殻が埋まり、安定することが確認できました。
まとめ
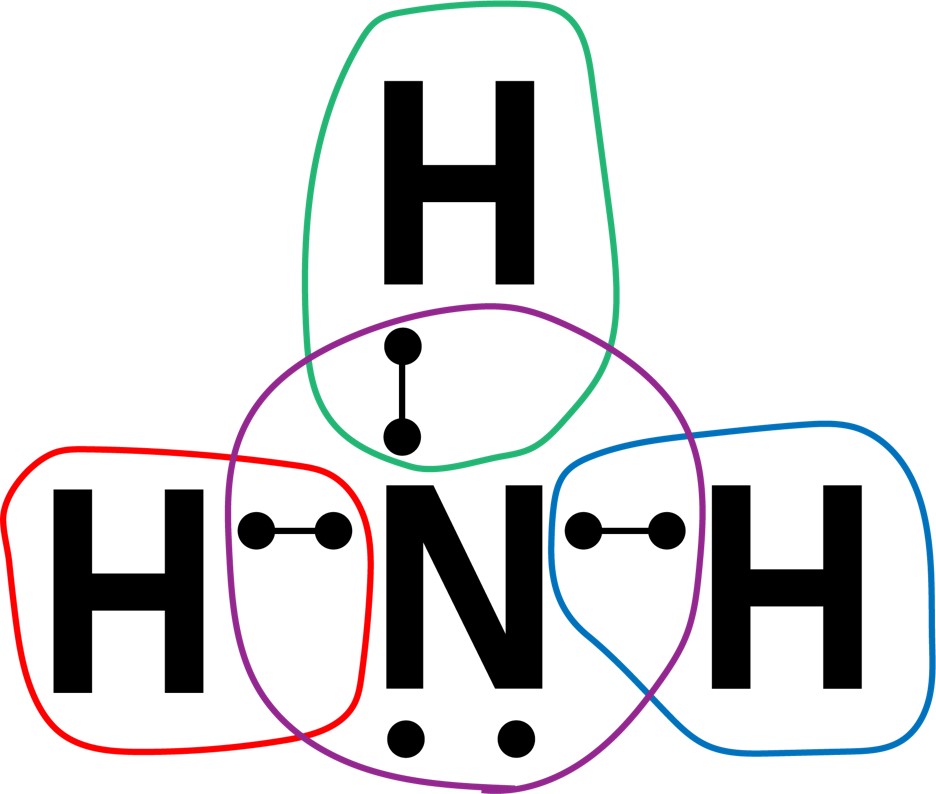
練習問題 問1 水素と酸素の最も外側の電子殻に入っている電子の数をそれぞれ答えよ。 問2 水素と酸素をそれぞれ電子式であらわせ。 問3 水素と酸素による水の生成(2H2 + O2 → 2H2O) の原子について、電子式であらわせ。 (難)問4 窒素(N)と水素(H)の合成によるアンモニアの生成について、化学式と電子式であらわせ。
・化学分解 …… 電気分解、熱分解など
そのエネルギーの与え方により、分解の名称がつけられています。
書き方は簡単。元素名の横に最外殻の電子数を・で書くだけです。
・を置く場所はどこでも構いません。
ただし、電子殻上に乗っているイメージを忘れないようにしましょう。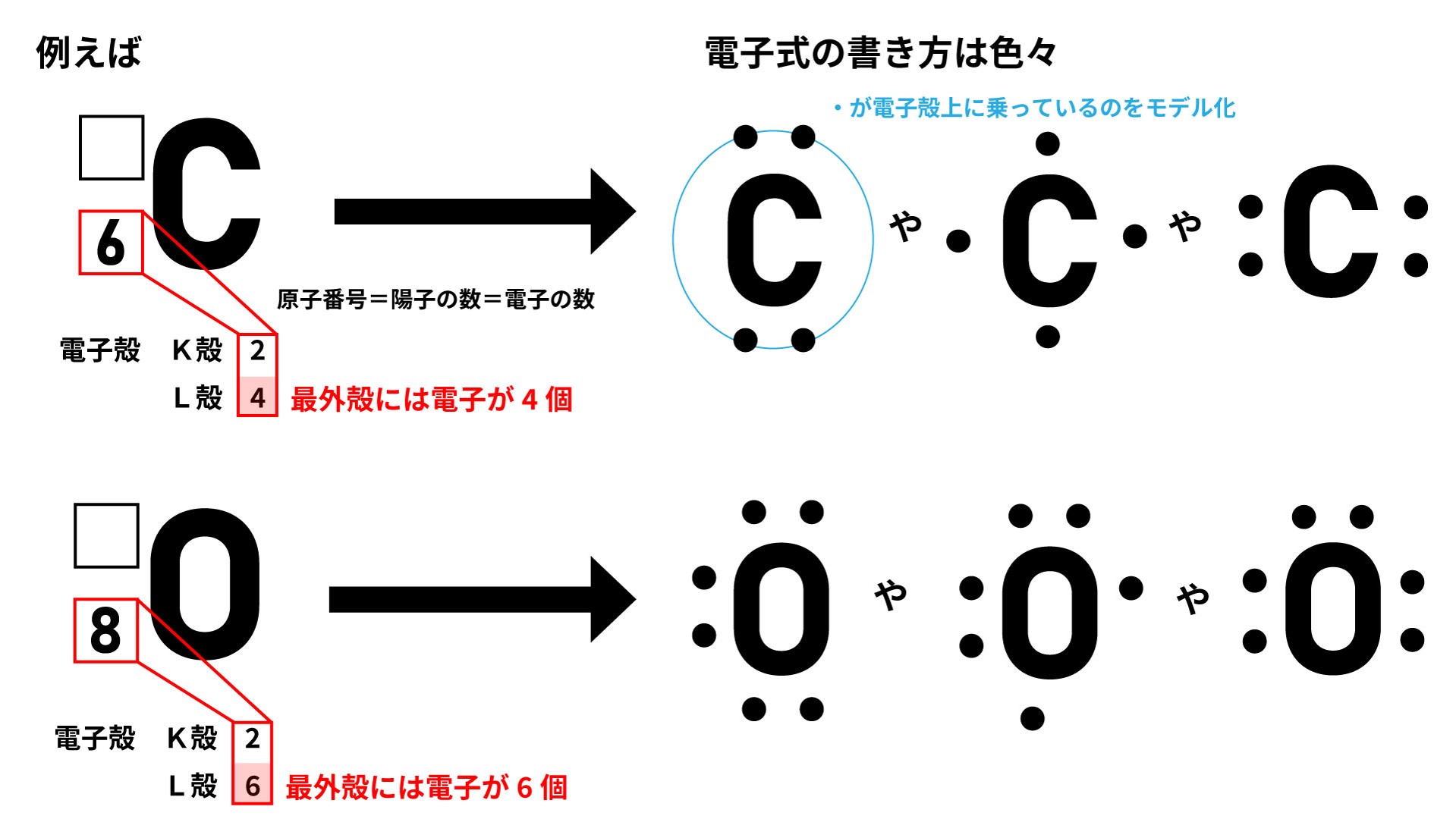
電子核
K殻
L殻
M殻
N殻
O殻
……
入れる
電子の数2
8
18
(8)32
50
2n2
HがH単体ではなく、H2となり、OがO2となるのもこの共有結合が理由です。
この基本を忘れないようにしてください。
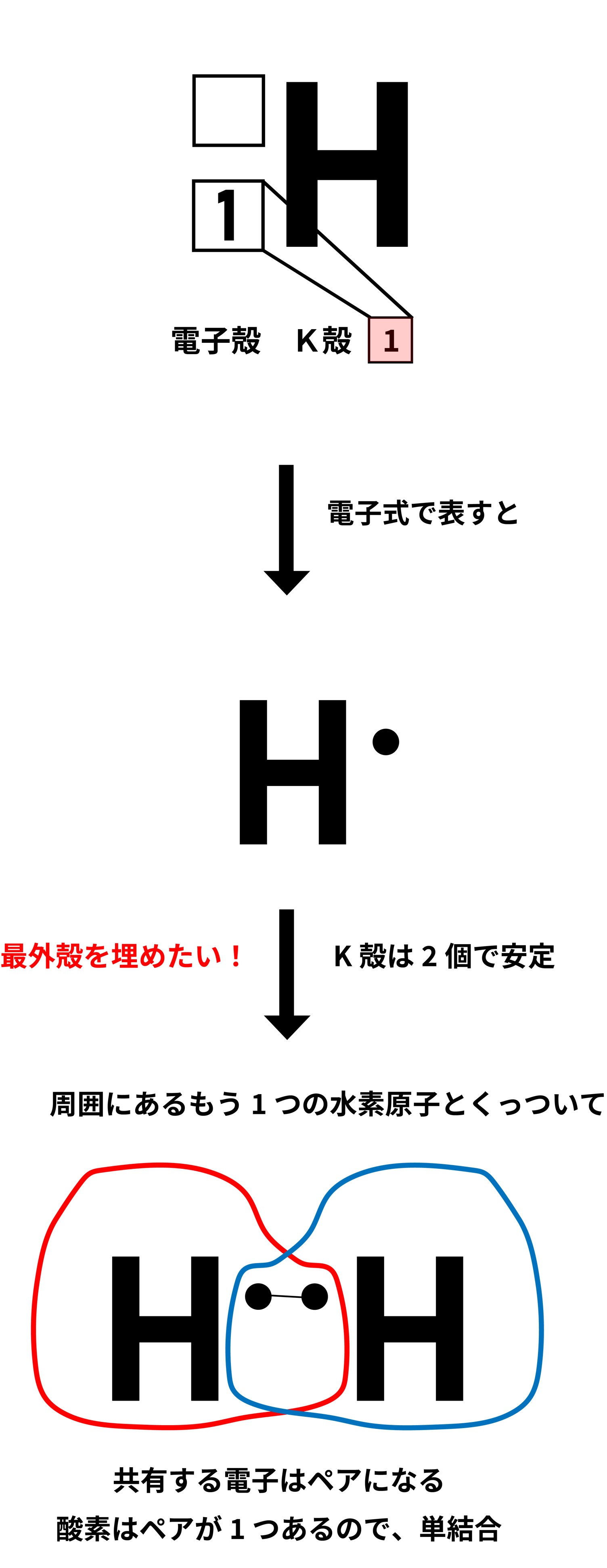
最外殻であるK殻の電子が2個になったので、1個しかなかったときよりも安定します。
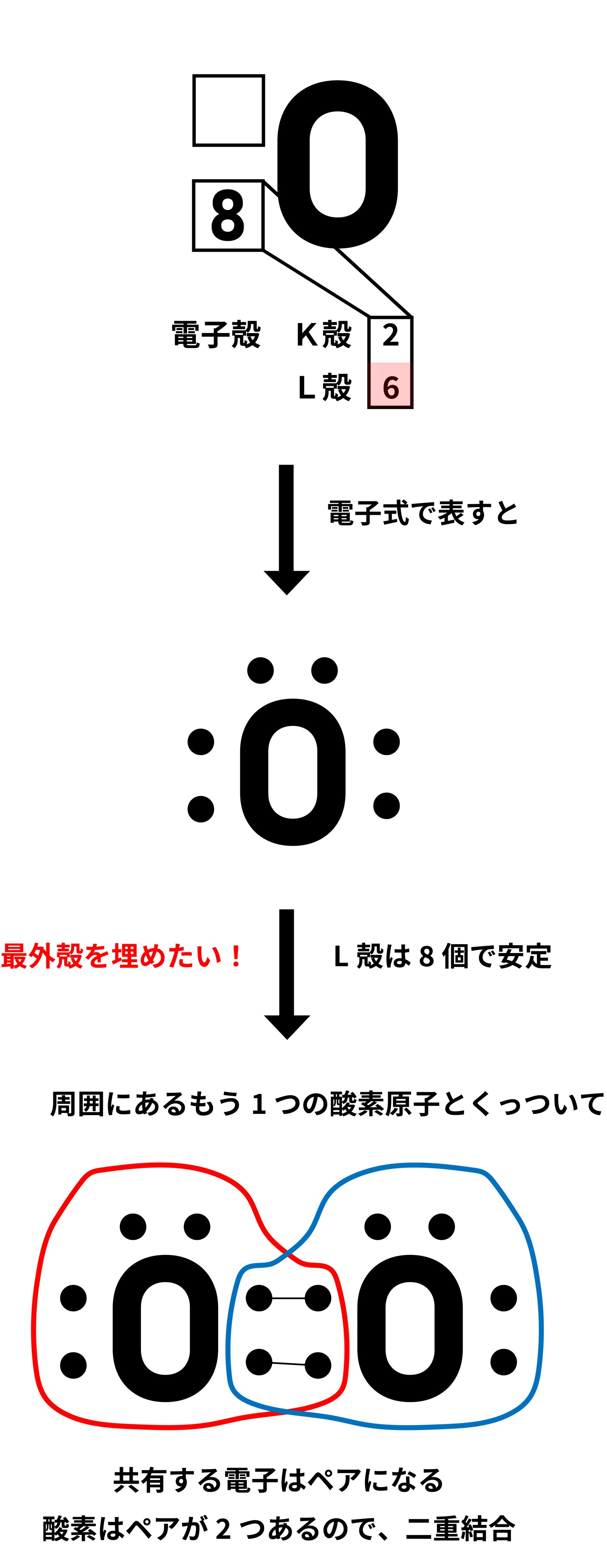
最外殻であるL殻の電子が8個になったので、6個しかなかったときよりも安定します。
【前提条件】
・炭素の元素記号はC、原子番号は6番
・酸素の元素番号はO、原子番号は8番
・酸素分子は周囲に無限に存在する。
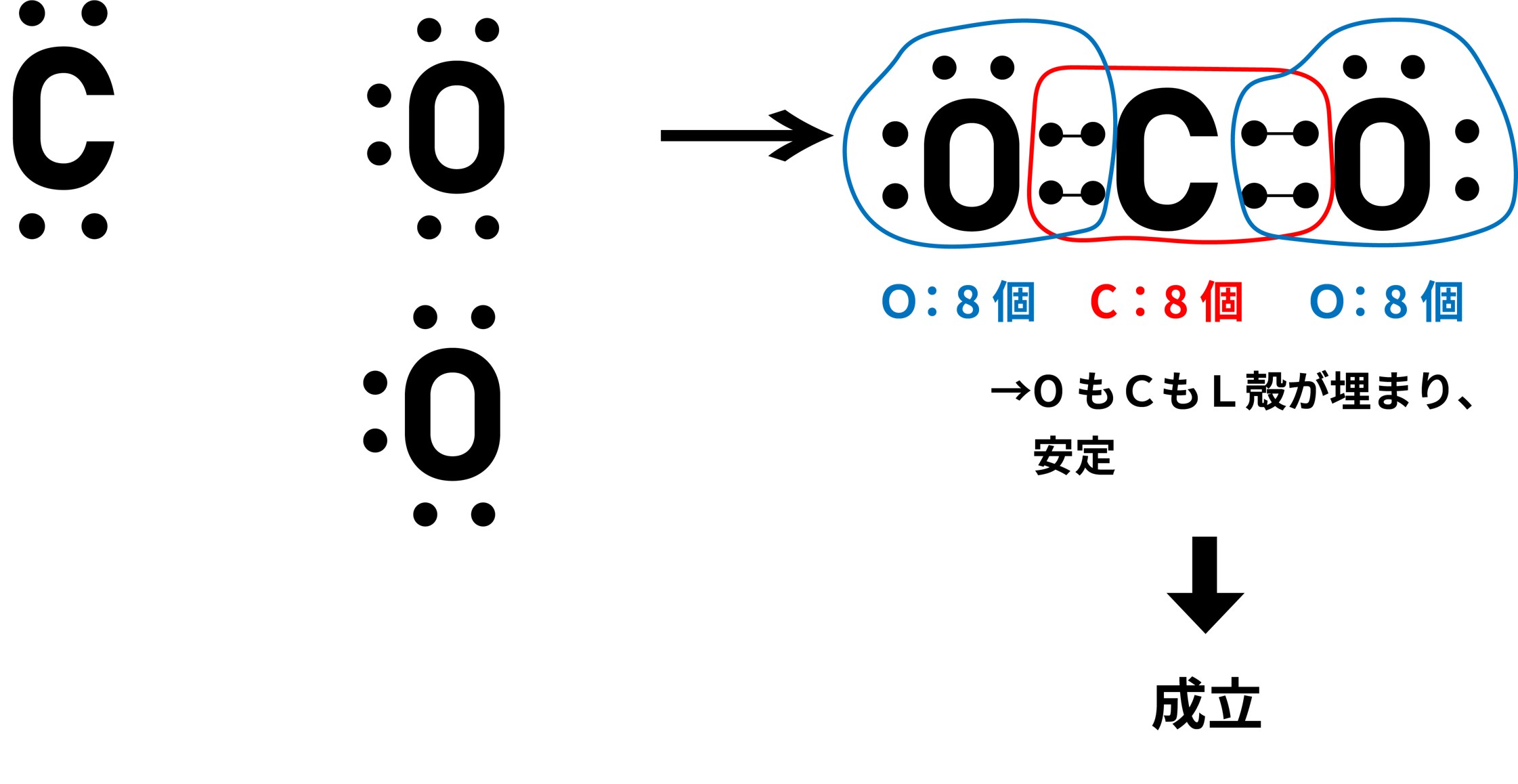
このように、原子は最外殻の電子を埋めて安定するために共有結合を起こすのです。
✔ 電子式の書き方を覚える。
✔ 安定するために、複数の原子同士で最外殻の電子を共有して結合することを共有結合という。
【関連ページ】